Phản ứng Al4C3 + H2O → CH4 + Al(OH)3
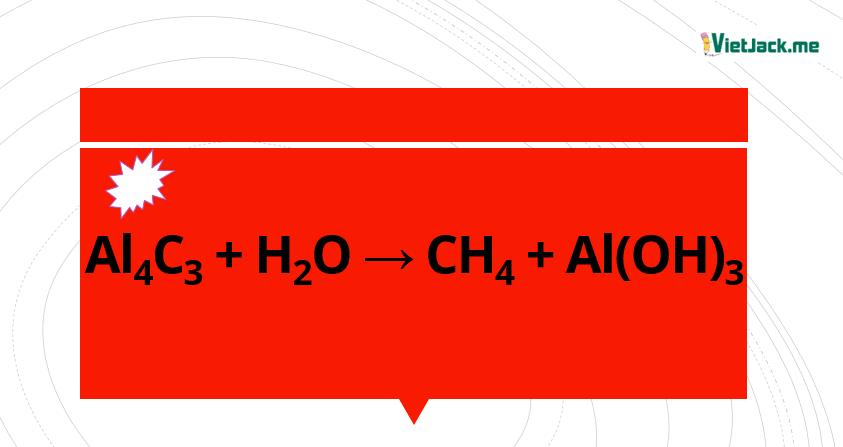
1. Phương trình điều chế CH4 từ Al4C3
Al4C3 + 12H2O → 4Al(OH)3↓ + 3CH4↑
2. Điều kiện phương trình phản ứng Al4C3 ra CH4
Nhiệt độ phòng
3. Cách thực hiện phản ứng điều chế metan trong phòng thí nghiệm
Cho Al4C3 tác dụng với nước.
4. Hiện tượng nhận biết phản ứng
Nhôm cacbua tan dần tạo kết tủa keo trắng, đồng thời có khí CH4 thoát ra.
5. Bản chất của Al4C3 (Nhôm cacbua) trong phản ứng
Al4C3 là chất tan được trong nước.
6. Một số phương pháp điều chế metan
6.1. Điều chế CH4 trong công nghiệp
Ở quy mô công nghiệp, cách thu khí CH4 và các đồng đẳng của nó được tách từ khí thiên nhiên và dầu mỏ. Đây là cách điều chế CH4 dễ dàng và nhanh chóng.
6.2. Cách điều chế metan trong phòng thí nghiệm
Một số cách điều chế CH4 trong phòng thí nghiệm như sau:
Khi cần một lượng nhỏ metan, người ta nung natri axetat chung với vôi tôi xút, hoặc điều chế metan bằng cách cho nhôm cacbua tác dụng với nước:
Điều chế CH4 từ nhôm cacbua:
Al4C3+ 12H2O → 4Al(OH)3+ 3CH4
Phản ứng muối natri axetat với xút tạo khí metan (nhiệt phân muối natri của axit carboxylic):
CH3-COONa + NaOH Na2CO3 + CH4
Cách điều chế metanol bằng phản ứng cộng hidro vào cacbon:
C + 2H2 CH4
Cách điều chế CH4 từ khí CO:
CO + 3H2 H2O + CH4
7. Ứng dụng của Metan
Metan là một trong những nhiên liệu vô cùng quan trọng. Nếu so với việc đốt cháy than đá thì đốt cháy metan sẽ sinh ra ít CO2 trên mỗi đơn vị nhiệt giải phóng.
Metan thường được sử dụng làm nhiên liệu cho các lò nướng, nhà cửa, máy nước nóng, lò nung, xe ôtô… Nó đốt cháy oxy để tạo ra nhiệt.
Metan dưới dạng khí tự nhiên nén được sử dụng làm nhiên liệu cho xe cộ và được đánh giá là thân thiện với môi trường.
Khí CH4 có vai trò quan trọng trong việc phát điện bằng cách đốt nó như một nhiên liệu trong tuabin khí. Hoặc máy phát điện hơi nước. Vì vậy ở nhiều nơi khí metan được biết đến là một loại khí thiên nhiên dùng để sưởi ấm và nấu ăn.
8. Tính chất hóa học của Al4C3
Tan trong nước:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Tác dụng với axit:
HCl + Al4C3 → AlCl3 + CH4
Tác dụng với dung dịch bazơ:
H2O + NaOH + Al4C3 → CH4 + NaAl(OH)2
9. Bài tập vận dụng
Câu 1. Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 3,92 lít khí CO2 (ở đktc) và 4,95 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
A. 70,0 lít.
B. 35 lít.
C. 84,0 lít.
D. 56,0 lít
Lời giải:
Đáp án: B
Giải thích:
nCO2 = 3,92/22,4 = 0,175 mol;
nH2O = 4,95/18 = 0,275 mol
Bảo toàn nguyên tố O:
2.nO2 = 2.nCO2 + nH2O
=> 2x = 0,175.2 + 0,275 => x = 0,3125
Thể tích không khí cần dùng là nhỏ nhất => oxi trong không khí phản ứng vừa đủ
=>VO2(đktc)= 0,3125 . 22,4 = 7 lít
VKhôngKhí(đktc)= 5.7 = 35 lít
Câu 2. Những phát biểu nào sau đây không đúng?
(1) Metan tác dụng với Clo khi có ánh sáng.
(2) Metan là chất khí, không màu, không mùi, nặng hơn không khí.
(3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất.
(4) Hỗn hợp giữa metan và clo là hỗn hợp nổ.
(5) Trong phân tử metan có bốn liên kết đơn C-H.
(6) Metan tác dụng với clo ở điều kiện thường.
A.1, 3, 5.
B. 1, 2, 6.
C. 2, 4, 6.
D. 2, 4, 5
Lời giải:
Đáp án: C
Giải thích:
Các phát biểu không đúng: 2, 4, 6
(2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí.
(4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai.
(6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Câu 3. Trong phòng thí nghiệm có thể thu khí CH4 bằng cách:
A. Đẩy không khí (ngửa bình)
B. Đẩy axit
C. Đẩy nước (úp bình)
D. Đẩy bazơ



















![Ảnh Anime Cute Phô Mai Que Đẹp [102+ Hình Siêu Cute]](/uploads/blog/2024/11/25/abe5e97926c8d9f39bb0d04c91c956cbbc32fbca-1732503618.jpg)

