Electron là thuật ngữ được nhắc đến nhiều nhưng không phải ai cũng hiểu rõ về chúng. Đây là một loại hạt ở vỏ ngoài của nguyên tử có cấu tạo và khối lượng đặc trưng. Trong bài viết hôm nay, VietChem sẽ phân tích chi tiết về Electron cũng như khối lượng E để các bạn tham khảo và hiểu rõ hơn về vấn đề này.
1. Hạt Electron là gì?
Trước khi tìm hiểu về khối lượng E các bạn hãy cùng khám phá hạt Electron. Hạt Electron còn được gọi bằng nhiều tên khác như: Hạt hạ, điện tử, hạt hạ nguyên tử. Chúng có ký hiệu là E. Điện tích của E tương đương - 1,6 x 10-19.
Hạt Electron có trọng lượng so với Proton mang điện tích dương chỉ xấp xỉ bằng 1/1836 lần. Đây là hạt mang điện tích âm bao quanh hạt nhân với vai trò quan trọng liên quan đến nhiệt điện, hóa học, từ học và độ dẫn điện.

Tìm hiểu về hạt Electron
2. Đặc điểm của Electron
E có tính sóng - tính hạt: Tính chất nổi bật của E là tính sóng - tính hạt. Chúng thể hiện được cả tính chất của hạt và của sóng. Ví dụ cụ thể như sau: Electron vừa phát xạ như hạt vật chất vừa có thể va chạm hoặc tính khúc xạ - giao thoa như sóng ánh sáng.
Khối lượng E rất nhỏ: Khối lượng E rất nhỏ tương đương 9,1094.10-31 kg. Vì thế, các hiệu ứng cơ học có thể làm ảnh hưởng đến E như hiệu ứng Compton hay nguyên lý bất định Heisenberg.
E có tính dẫn điện: Tính chất dẫn điện của E ở khả năng di chuyển. Điều này thể hiện như sau: Khi điện trường bên ngoài tác động, các vật chất có thể chuyển động. Tùy thuộc vào việc di chuyển của Electron tự do hay số lượng E mà các vật chất có độ dẫn điện khác nhau.
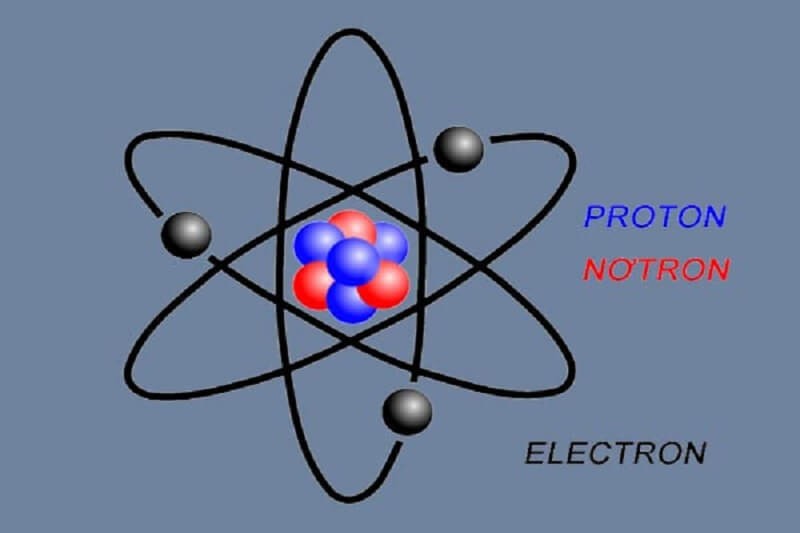
Khối lượng E rất nhỏ và có tính dẫn điện, tính sóng - tính hạt
Electron có spin: Spin là đại lượng lượng từ. Chúng có hai giá trị bao gồm -1/2 hoặc +1/2. Đây là đại lượng lượng từ mang đến tính chất liên kết hóa trị hoặc từ tính.
Electron có tính lưỡng cực từ: Khả năng hình thành từ trường xung quanh mình là một trong nhưng tính chất thể hiện tính lưỡng cực của Electron. Đây chính là sự kết hợp giữa quỹ đạo và spin.
3. Cấu tạo và khối lượng E
Electron không có cấu trúc bên trong theo cấu tạo. Bởi chúng không có khả năng mở rộng ra không gian mà chỉ là 1 hạt điểm với các hạt tích điểm. Con người không thể nhìn thấy bằng mắt thường bởi chúng nằm trong vật chất với kích thước rất nhỏ.
Trong khi đó, cấu tạo của hạt nhân nguyên tử bao gồm lớp vỏ và hạt nhân với kích thước khoảng 0.1nm, tương đương 10-10m. Cụ thể:
3.1. Lớp vỏ ngoài
Chính là các hạt Electron mang điện tích âm, sắp xếp theo từng lớp. Mỗi lớp sẽ có số lượng E nhất định và chúng quay xung quanh không gian hạt nhân.
Những hạt E này rất nhẹ và thường bị các hạt Proton mang điện tích dương hút lại. Số lượng hạt Electron luôn bằng số lượng hạt Proton để trung hòa về điện.
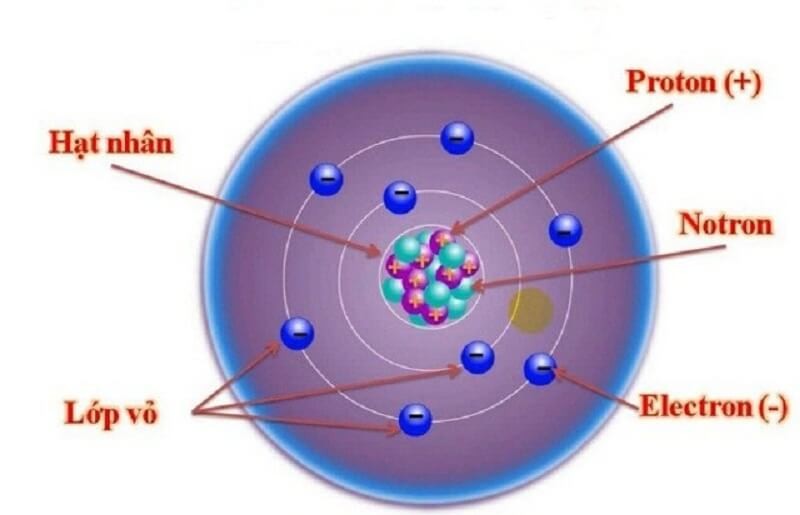
Lớp vỏ ngoài của nguyên tử là các Electron mang điện tích âm
3.2. Hạt nhân
Hạt nhân nằm ở giữa. Hạt nhân có kích thước 10-5 - 10-4 so với nguyên tử. Hạt nhân bao gồm hạt Proton và hạt Nơtron với đặc điểm như sau:
- Hạt Proton ký hiệu là P, mang điện tích dương. Chúng có khối lượng 1,6726.10-27kg, với điện tích + 1,602.10-19C.
- Hạt Neutron ký hiệu là N, mang điện tích trung hòa. Chúng có khối lượng 1,6748.10-27kg và điện tích bằng 0.
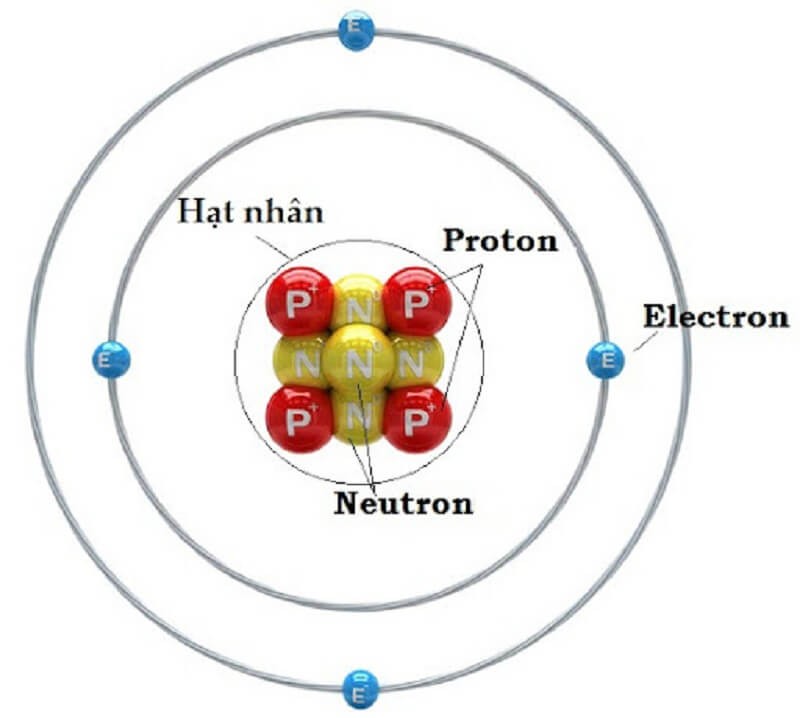
Cấu tạo nguyên tử gồm lớp vỏ và hạt nhân
4. Cách viết cấu hình Electron
Khối lượng E là bao nhiêu đã được phân tích khá chi tiết ở phần trên. Ngoài ra, cấu hình E có cách viết khá đơn giản theo hướng dẫn từng bước dưới đây:
- Bước 1: Xác định số Electron của nguyên tử dựa vào bảng tuần hoàn các nguyên tố hóa học.
- Bước 2: Phân bố E tăng dần theo mức tăng năng lượng AO. Đây là bước quan trọng dựa vào quy tắc Hund và nguyên lý Pau-li.
- Bước 3: Tiến hành viết cấu hình E theo phân lớp trong 1 lớp. Đồng thời, viết theo thứ tự từng lớp Electron.
- Bước 4: Thu gọn lại cách viết ở trên.
Ví dụ: Nguyên tử Zn trong bảng tuần hoàn các nguyên tố hóa học có Z = 30.
Khi đó: Số Electron của Zn là 30e phân bổ như sau: 1s22s22p63s23p64s23d10.
Lớp 3d10 và 4s2 bị chèn năng lượng của nhau nên có thể viết thành: 1s22s22p63s23p63d104s2. Sau đó viết gọn là [Ar] 3d104s2. Trong đó, [Ar] chính là viết tắt của cấu hình E cho nguyên tố Argon.
5. Bài tập về khối lượng E
Từ những lý thuyết trên, các bạn có thể tham khảo một số bài tập về khối lượng E và lời giải dưới đây:
Bài tập 1: So sánh Magie với Cacbon. Nguyên tử nào nặng hơn và hơn bao nhiêu lần?
Trả lời: Nguyên tử khối của Mg và Cacbon lần lượt là 24 đvC và 12 đvC. Vì thế, nguyên tử Magie nặng hơn nguyên tử Cacbon 2 lần.
Bài tập 2: Khối lượng của nguyên tử A gấp 4 lần nguyên tử Nitơ. Vậy khối lượng nguyên tử của A là bao nhiêu và A là nguyên tố nào?
Trả lời: Ni tơ có nguyên tử khối là 14 đvC. Vì thế, nguyên tử khối của A sẽ là:
14 x 2 = 56 đvC. Vậy A chính là Fe - sắt.
Electron xuất hiện ở nhiều hiện tượng tự nhiên và được ứng dụng phổ biến trong công nghệ khoa học kỹ thuật. Hy vọng những chia sẻ của VietChem sẽ giúp ích cho các bạn hiểu rõ hơn về khối lượng E và một số thông tin liên quan. Từ đó biết cách giải bài tập về Electron và giải đáp những vấn đề mà mình quan tâm.



















![Ảnh Anime Cute Phô Mai Que Đẹp [102+ Hình Siêu Cute]](/uploads/blog/2024/11/25/abe5e97926c8d9f39bb0d04c91c956cbbc32fbca-1732503618.jpg)

