Lý thuyết Hoá 12 Bài 21: Điều chế kim loại
Bài giảng Hoá 12 Bài 21: Điều chế kim loại
I. Nguyên tắc điều chế kim loại
Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
Mn+ + ne → M
II. Phương pháp điều chế kim loại
Tùy thuộc vào độ hoạt động hóa học của kim loại mà người ta lựa chọn phương pháp điều chế phù hợp.
1. Phương pháp nhiệt luyện
- Nguyên tắc: Khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt động (như Al).
- Phạm vi áp dụng: Sản xuất các kim loại có tính khử trung bình (Zn, Fe, Sn, Pb,…) trong công nghiệp.
- Ví dụ:
Fe2O3 + 3CO →to 2Fe + 3CO2
2. Phương pháp thuỷ luyện
- Nguyên tắc: Dùng những dung dịch thích hợp như: H2SO4, NaOH, NaCN,… để hoà tan kim loại hoặc các hợp chất của kim loại và tách ra khỏi phần không tan có ở trong quặng. Sau đó khử những ion kim loại này trong dung dịch bằng những kim loại có tính khử mạnh hơn như Fe, Zn,…
- Phạm vi áp dụng: Thường sử dụng để điều chế các kim loại có tính khử yếu.
- Ví dụ dùng Fe để khử ion Cu2+ trong dung dịch muối đồng.
Fe + CuSO4→ FeSO4 + Cu↓
Fe + Cu2+ → Fe2+ + Cu↓
3. Phương pháp điện phân
a.Điện phân hợp chất nóng chảy
- Nguyên tắc: Khử các ion kim loại bằng dòng điện bằng cách điện phân nóng chảy hợp chất của kim loại.
- Phạm vi áp dụng: Điều chế các kim loại hoạt động hoá học mạnh như K, Na, Ca, Mg, Al…
- Ví dụ điện phân Al2O3 nóng chảy là phương pháp sản xuất nhôm trong công nghiệp.
+ Ở catot (cực âm): Al3+ + 3e → Al
+ Ở anot (cực dương): 2O2- → O2 + 4e
Phương trình điện phân: 2Al2O3 4Al + 3O2
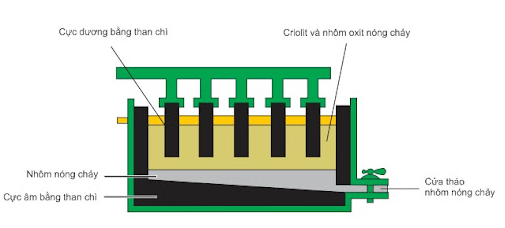
Sơ đồ thùng điện phân Al2O3 nóng chảy
b.Điện phân dung dịch
- Nguyên tắc: Khử các ion kim loại bằng dòng điện bằng cách điện phân dung dịch muối của kim loại.
- Phạm vi áp dụng: Điều chế các kim loại có độ hoạt động hoá học trung bình hoặc yếu như Zn, Cu …
- Ví dụ điện phân dung dịch CuCl2 để điều chế Cu:
+ Ở catot: Cu2+ + 2e → Cu
+ Ở anot: 2Cl- → Cl2 + 2e
Phương trình điện phân: CuCl2 →dpdd Cu + Cl2
c. Tính lượng chất thu được ở các điện cực
Dựa vào công thức Farađây, có thể tính được khối lượng các chất thu được ở điện cực:
m=AItnF trong đó:
m: Khối lượng chất thu được ở điện cực (gam).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe)
t: Thời gian điện phân (giây)
F: Hằng số Farađây (F = 96500).
Trắc nghiệm Hóa học 12 Bài 21: Điều chế kim loại
Câu 1: Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp nào sau đây?
A. Điện phân dung dịch
B. Điện phân nóng chảy
C. Thủy luyện
D. Nhiệt luyện
Hướng dẫn giải:
Đáp án B
Phương pháp điện phân nóng chảy dùng để điều chế kim loại có tính khử mạnh (kim loại nhóm IA, IIA và Al)
Câu 2: Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
A. khử
B. cho proton
C. bị khử
D. nhận proton
Hướng dẫn giải:
Đáp án C
Điều chế kim loại là quá trình khử ion kim loại thành kim loại
Rn+ + ne → R
Ion kim loại Rn+ đóng vai trò là chất oxi hóa (chất bị khử)
Câu 3: Để điều chế Al kim loại ta có thể dùng phương pháp nào trong các phương pháp sau đây?
A. Dùng Zn đẩy AlCl3 ra khỏi muối
B. Dùng CO khử Al2O3
C. Điện phân nóng chảy Al2O3
D. Điện phân dung dịch AlCl3
Hướng dẫn giải:
Đáp án C
Kim loại nhôm được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
2Al2O3 →dpnc 4Al + 3O2
Câu 4: Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là
A. Ca và Fe
B. Mg và Zn
C. Na và Cu
D. Fe và Cu
Hướng dẫn giải:
Đáp án D
Phương pháp nhiệt luyện là phương pháp điều chế kim loại bằng cách dùng chất khử mạnh như H2, CO, C, NH3, Al khử các oxit kim loại ở nhiệt độ cao.
Phương pháp nhiệt luyện dùng để điều chế kim loại đứng sau Al trong dãy hoạt động hóa học.
Câu 5: Cho các chất sau đây: NaOH, Na2CO3, NaCl, NaNO3 và Na2SO4. Có bao nhiêu chất điều chế được Na chỉ bằng 1 phản ứng ?
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải:
Đáp án B
Điện phân nóng chảy NaOH và NaCl
4NaOH →dpnc 4Na + O2 + 2H2O
2NaCl →dpnc 2Na + Cl2
Câu 6: Tiến hành các thí nghiệm sau:
(a) Điện phân MgCl2 nóng chảy
(b) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư
(c) Nhiệt phân hoàn toàn CaCO3
(d) Cho kim loại Na vào dung dịch CuSO4 dư.
(e) Dẫn khí H2 dư đi qua bột CuO nung nóng.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kim loại là
A. 3
B. 4
C. 1
D. 2
Hướng dẫn giải:
Đáp án A
→ Phản ứng (a), (b), (e) thu được kim loại
Câu 7: Để điều chế Ca từ CaCO3 cần thực hiện ít nhất mấy phản ứng?
A. 2
B. 3
C. 4
D. 5
Hướng dẫn giải:
Đáp án A
Phản ứng (1):
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Phản ứng (2): CaCl2 →dpnc Ca + Cl2
Câu 8: Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2
B. Điện phân dung dịch MgSO4
C. Cho kim loại K vào dung dịch Mg(NO3)2
D. Cho kim loại Fe vào dung dịch MgCl2
Hướng dẫn giải:
Đáp án A
MgCl2 →dpnc Mg + Cl2
Câu 9: Những kim loại nào sau đây có thể được điều chế từ oxit bằng phương pháp nhiệt luyện nhờ chất khử CO?
A. Zn, Mg, Fe
B. Ni, Cu, Ca
C. Fe, Ni, Zn
D. Fe, Al, Cu
Hướng dẫn giải
Đáp án C
Phương pháp nhiệt luyện dùng để điều chế kim loại đứng sau Al trong dãy hoạt động hóa học
Câu 10: Khi điện phân dung dịch CuCl2 để điều chế kim loại Cu, quá trình xảy ra ở catot (cực âm) là
A. Cu2+ + 2e → Cu
B. Cl2 + 2e → 2Cl-
C. Cu → Cu2+ + 2e
D. 2Cl- → Cl2 + 2e
Hướng dẫn giải:
Đáp án A
Ở catot (cực âm) xảy ra quá trình khử ion kim loại hoặc nước.
Cu2+ +2e → Cu
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 12 đầy đủ, chi tiết khác:
Lý thuyết Bài 22: Luyện tập tính chất của kim loại
Lý thuyết Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
Lý thuyết Bài 1: Este
Lý thuyết Bài 2: Lipit
Lý thuyết Bài 3: Khái niệm về xà phòng và chất giặt rửa tổng hợp