Chuyển đổi benzen ra toluen là một phương pháp sản xuất đơn giản và hiệu quả, cho phép chúng ta tạo ra toluen từ các nguồn nguyên liệu tự nhiên như benzen. Toluene, với các tính chất hóa học tương đồng với benzen, là cơ sở nhiều ngành công nghiệp khác nhau như hóa chất, dược phẩm, sản xuất nhựa và sơn. Hãy cùng Ihoc tìm hiểu kỹ hơn về quá trình này.

Tìm hiểu về hai chất hóa học benzen ra toluen
Benzen là chất gì?
Benzen là một hợp chất hữu cơ với công thức hóa học C6H6. Đây là một hydrocarbon aromatique, thuộc nhóm hợp chất ancol, có cấu trúc phẳng và bền do sự liên kết pi liên tục trong hệ thống vòng của nó. Đây là một trong những hợp chất hữu cơ quan trọng nhất và được sử dụng rộng rãi trong ngành công nghiệp hóa chất.
Tính chất vật lý của benzen:
- Trạng thái: Benzen ở dạng chất lỏng ở nhiệt độ phòng.
- Màu sắc: Nó không màu.
- Mùi hương: Nó có một mùi hương đặc trưng và ngọt ngào.
- Điểm nóng chảy: Benzen chảy ở nhiệt độ 5.5 độ C (42 độ F).
- Điểm sôi: Nó sôi ở nhiệt độ 80.1 độ C (176.2 độ F).
Tính chất hóa học của benzen:
1. Tác dụng với halogen:
- C6H6 + Br2 → C6H5Br + HBr
2. Phản ứng nitro hoá:
- C6H6 + HO − NO2 → C6H5 − NO2 + H2O
3. Phản ứng cháy:
- H6 + 15O2 (nhiệt độ) → 12CO2 + 6H2O
4. Phản ứng cộng:
- C6H6 + 3H2 → C6H12
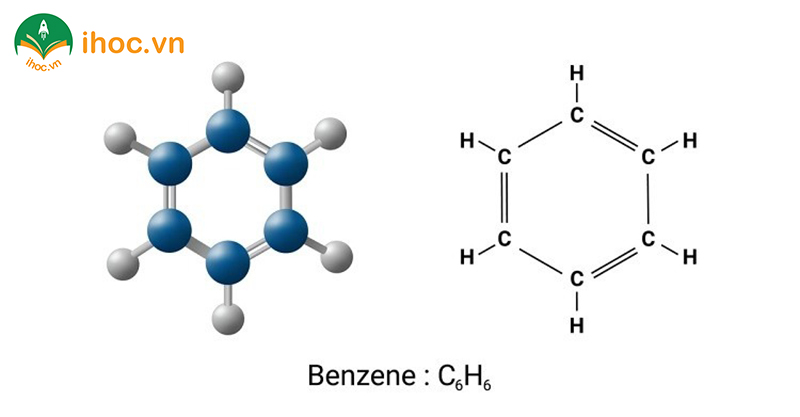
Toluen là chất gì?
Toluen (hay còn được gọi là methylbenzen) là một hydrocarbon aromatique chứa một nhóm methyl (CH₃) được gắn vào vị trí ortho, meta hoặc para của nhân benzene. Công thức hóa học của toluen là C₇H₈. Đây là một chất lỏng không màu, có mùi hơi đặc trưng, và là một dung môi quan trọng trong công nghiệp và hóa học.
Tính chất vật lý của toluen:
- Trạng thái: Toluen ở điều kiện phòng là một chất lỏng không màu.
- Nhiệt độ sôi: Nhiệt độ sôi của toluen là khoảng 110 °C (230 °F).
- Khối lượng riêng: Khối lượng riêng của toluen là khoảng 0.87 g/cm³.
Tính chất hóa học của toluen:
1. Toluen tham gia vào phản ứng với brom khô để tạo ra brom toluen và axit hydrobromic (HBr):
- Br2 + C6H5CH3 → HBr + C6H5CH2Br
2. Dưới tác dụng của ánh sáng, điều chế toluen tương tác với khí clo để tạo ra diclometan và axit hydrochloric (HCl):
- Cl2 + C6H5CH3 → C6H5CH2Cl + HCl
3. Trong phản ứng nitro hóa, toluen phản ứng với nitro để tạo ra nitrotoluen và nước.
4. Toluen tác động với hydro (H2) trong một quá trình cộng để tạo thành metylxiclohexan.
5. Trong quá trình oxy hóa, toluen trải qua reaksi với nhóm metyl của mình.
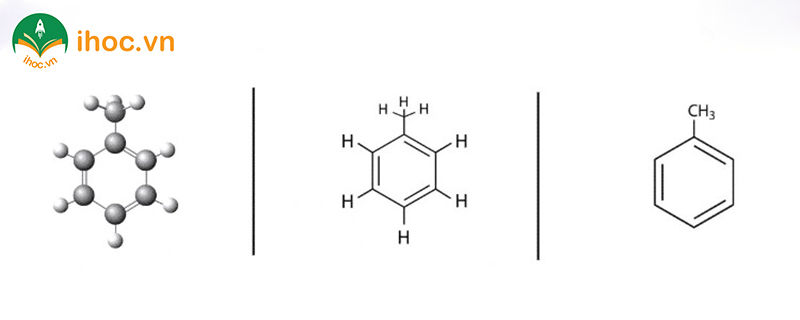
Đặc điểm chung của benzen và toluen
Cả benzen và toluen đều là các hydrocarbon aromatique, điều này có nghĩa là chúng đều có một vòng benzen (hoặc vòng phenyl) trong cấu trúc hóa học của mình. Dưới đây là một số điểm chung của benzen và toluen:
Cấu trúc hóa học:
- Benzen: Công thức hóa học của benzen là C₆H₆. Nó có một cấu trúc vòng hình tròn với các nguyên tử cacbon xen kẽ liên kết với các nguyên tử hydro. Mỗi nguyên tử cacbon và hydro trong benzen đều đóng vai trò quan trọng trong các phản ứng hóa học.
- Toluen: Công thức hóa học của toluen là C₇H₈. Nó là một dẫn xuất của benzen, trong đó một nguyên tử hydro của benzen đã được thay thế bằng một nhóm methyl (CH₃). Điều này tạo ra một cấu trúc vòng hình tròn với một nhóm methyl gắn vào vị trí ortho, meta hoặc para của benzen.
Dung tích hóa học: Cả benzen và toluen đều là các chất lỏng không màu ở điều kiện phòng. Tuy nhiên, toluen có một chút dày hơn benzen do sự hiện diện của nhóm methyl.
Tính chất hoá học: Cả benzen và toluen đều tham gia vào các phản ứng hóa học tích cực do có cấu trúc hóa học đặc biệt của vòng benzen, bao gồm bromation, nitration và các phản ứng hóa học khác.
Dung tích hòa tan: Cả benzen và toluen đều hòa tan trong các dung môi hữu cơ khác như ethanol, ether và acetone. Chúng không hòa tan trong nước do tính chất không phân cực của chúng.
Ứng dụng công nghiệp: Cả benzen và toluen đều được sử dụng như là dung môi trong các ứng dụng công nghiệp, trong sản xuất thuốc nhuộm, nhựa, sơn và keo, cũng như trong các ngành công nghiệp hóa chất và dược phẩm.

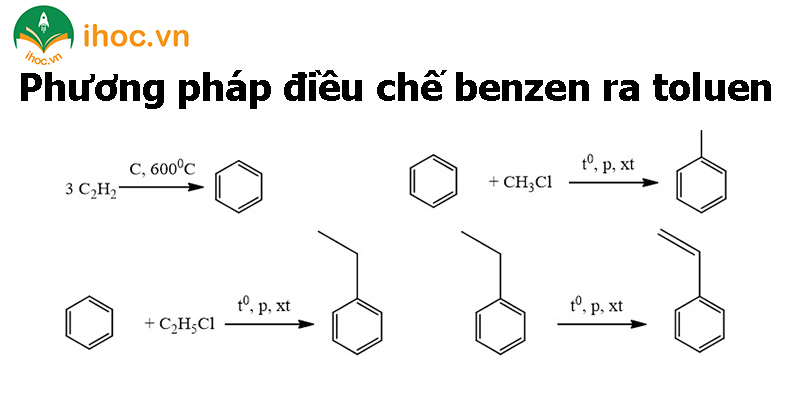
Phương pháp điều chế benzen ra toluen
Toluen là một trong những dung môi có ứng dụng vô cùng cao, quá trình sản xuất toluen mang lại lợi nhuận lớn và thu hút sự quan tâm của nhiều nhà đầu tư. Vì vậy, nghiên cứu về cách điều chế toluen là một lĩnh vực đang được tập trung và quan tâm rộng rãi. Toluene có thể được tổng hợp cả trong phòng thí nghiệm và trong quy trình sản xuất công nghiệp, thông qua các phương pháp sau:
Cách điều chế từ benzen ra toluen: Toluene là một thành viên trong dãy đồng đẳng của benzen, cho nên nó có thể dễ dàng được tổng hợp từ benzen thông qua phản ứng với CH₃Cl, với sự xúc tác của AlCl₃ hoặc acid Lewis, tạo ra toluen và axit HCl. Phương trình minh họa:
- C6H6 + Cl-CH3 → CH3-C6H5 + HCl (xúc tác AlCl3 hoặc FeCl3 hay acid lewis)
Dựa vào phương pháp điều chế, toluen có thể được sản xuất thông qua quá trình chưng cất dầu mỏ và nhựa than đá. Ngoài ra, nó cũng có thể được sản xuất từ ankan hoặc xicloankan, qua các phản ứng hóa học như sau:
- CH3[CH2]5CH3 → C6H5CH3 (xúc tác, nhiệt độ, -4H2)
Cho benzen tương tác với clo để tạo ra C₆H₅Cl và axit hydrochloric (HCl). Tiếp theo, C₆H₅Cl phản ứng với CH₃Cl dưới sự tác dụng của natri (Na) để điều chế toluen. Phương trình hóa học minh họa cho quá trình này như sau:
- C6H6 + Cl2 → C6H5Cl + HCl
- C6H5Cl + CH3Cl + 2Na → C7H8 + 2NaCl
Trong ba phương pháp đề cập, việc chuyển đổi benzen ra toluen thông qua phản ứng là phương pháp đơn giản và ngắn gọn nhất. Tuy nhiên, để thực hiện phương pháp này, nguyên liệu cần thiết là benzen, điều này tạo ra một thách thức từ góc độ kinh tế vì đòi hỏi nguồn nguyên liệu riêng biệt. Do đó, về mặt chi phí và hiệu quả kinh tế, phương pháp này thường không được áp dụng trong quy trình sản xuất hàng loạt, mà thường chỉ được sử dụng trong các nghiên cứu và thí nghiệm nhỏ.
Điều chế toluen
Ngoài việc chuyển đổi benzen ra toluen, chúng ta còn có thể tạo ra các sản phẩm hóa học khác từ toluen. Trong ngành hóa sinh, toluen được sử dụng để tách hemoglobin từ tế bào hồng cầu.
Đồng thời, từ toluen, chúng ta cũng có thể sản xuất axit benzoic và nhiều chất hóa học khác. Một ứng dụng nổi bật của toluen là việc điều chế chất nổ TNT. Quá trình này liên quan đến phản ứng hóa học sau đây:
- C7H8 + 3HNO3 → C7H5(NO2)3 + 3H2O (xúc tác H2SO4 đặc)
Để điều chế rượu benzylic, có thể sử dụng toluen như một chất khởi đầu. Trong quá trình này, toluen tác dụng với clo để tạo thành benzyl clorua và khí hydro clorua. Sau đó, benzyl clorua mới tạo thành tác dụng với nước xúc tác (NaOH) để chuyển đổi thành rượu benzylic và natri clorua:
- C6H5-CH3 + Cl2 → C6H5-CH2-Cl + HCl
- C6H5-CH2-Cl + NaOH (dd) → C6H5-CH2-OH + NaCl
Sản xuất axit benzoic từ toluen dựa trên quá trình oxi hóa-khử với KMnO4 tạo ra axit benzoic, mangan sunfat, kali sunfat và nước:
- 5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5-COOH + 6MnSO4 + 3K2SO4 + 14H2O
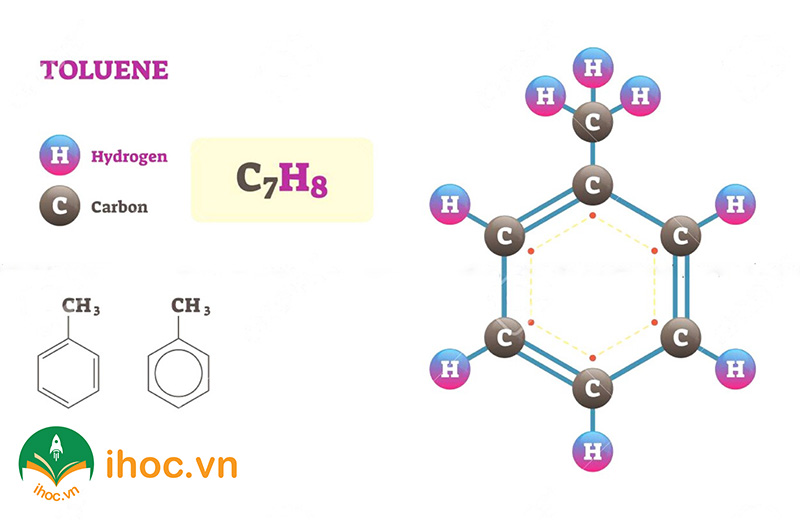
Vì sao benzen và toluen là nhóm chất đồng đẳng?
Ngoài phản ứng benzen ra toluen thì hai chất này còn được coi là nhóm chất đồng đẳng do chúng có các đặc điểm cấu trúc và tính chất hóa học tương đồng. Cả hai chất này đều chứa một vòng hexagon liên kết pi, còn được gọi là hợp chất aromatic, với các nguyên tử cacbon và hydro xen kẽ xen kẽ trong cùng một mạch phân tử.
Benzen và toluen đều có công thức phân tử C₆H₆, tương ứng với việc mỗi phân tử chứa 6 nguyên tử cacbon và 6 nguyên tử hydro. Sự khác biệt duy nhất giữa hai chất này là toluen có một nhóm metyl (CH₃-) thay thế một nguyên tử hydro của benzen. Điều này không làm thay đổi cấu trúc hexagon của vòng benzen, chỉ đơn giản là thêm một nhóm metyl vào một trong số các vị trí của benzen.
Cấu trúc phân tử benzen và toluen đều bao gồm một hệ liên kết pi liên tục trên vòng cacbon, tạo thành một hệ electron đặc biệt được gọi là hệ pi delocalized. Hệ liên kết pi delocalized này cho phép electron di chuyển tự do trong vòng, tạo nên tính chất hóa học đặc trưng của benzen và toluen.

Ihoc hy vọng rằng những thông tin trên giúp các bạn hiểu rõ tính chất của benzen, toluen và đặc biệt là quá trình chuyển hóa benzen ra toluen. Ngoài ra, đừng quên theo dõi Sách giáo khoa hóa học lớp 11 để có thêm nhiều thông tin hữu ích cho việc học nhé!



















![Ảnh Anime Cute Phô Mai Que Đẹp [102+ Hình Siêu Cute]](/uploads/blog/2024/11/25/abe5e97926c8d9f39bb0d04c91c956cbbc32fbca-1732503618.jpg)

